Cell:口服母亲肠道菌群可恢复剖宫产婴儿菌群失衡
新生儿的菌群定植是影响其日后健康的关键过程,而正常定殖过程的最强力破坏因素之一是剖宫产(cesarean section,CS)。这种分娩方式有效地消除了肠道菌群从母亲到婴儿的自然垂直传播的可能性,从而导致了婴儿特别是在出生后六个月内肠道内微生物组发育的偏离【1】。然而目前,全球范围内剖宫产的比例正在逐渐增加,在某些地区甚至影响可达50%。越来越多的证据表明,剖宫产会增加婴儿日后罹患慢性免疫疾病的风险。丹麦最近一项针对250万例于1982年至2010年间出生,并长达40年随访的研究表明,与通过阴道分娩的婴儿相比,其患炎症性肠病,类风湿性关节炎,腹腔疾病和1型糖尿病的风险增加【2】。值得注意的是,除了对个体的影响之外,这种影响菌群垂直传播的方式可能具有代际效应(Intergenerational Effect),即如果消除了肠道细菌从母体到子代的传递,与宿主共同适应了几千年的某些互利共生菌是否有可能永久消失【3】。因此,肠道菌群对于婴儿发育的重要性,使得“早期校正由剖宫产引起的菌群失衡的需求”被提出。2020年10月1日,来自赫尔辛基大学医学院的Willem M. de Vos课题组在Cell杂志上发表了题为 Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study 的文章,研究人员通过令婴儿出生后口服母体粪便微生物移植物(fecal microbiota transplantation, FMT),以评估这种方式否是可以恢复剖宫产足月婴儿受干扰的肠道菌群发育。 对于剖宫产婴儿肠道菌群组定殖而言,最天然的接种物则是母体粪便。在这项研究中,研究人员从17名选择剖宫产分娩方式的母体中筛选出7名参与婴儿的产后FMT(即婴儿首次哺乳时通过口服方式接受母体粪便移植物)。在随后的随访中对婴儿的体征评估正常后,通过16S rRNA基因扩增子测序对婴儿的肠道菌群进行分析,并与母体进行比较。结果显示,接受FMT处理的婴儿样本中的菌群与母体菌群有很大差异,表明移植后微生物在婴儿肠道内的高度选择性生长。 接下来,研究人员从阴道分娩和剖宫产分娩(未经FMT处理)婴儿中收集82个样本并分析其菌群组成。与未经FMT处理的剖宫产婴儿相比,FMT处理后的婴儿总体菌群发育与经阴道分娩的婴儿更相似。为了进一步详细阐明FMT处理婴儿的菌群发育状况,研究人员测试了阴道分娩婴儿与剖宫产分娩的处理和未处理婴儿之间的菌群差异。结果显示,与经阴道分娩的婴儿相比,剖宫产分娩婴儿的拟杆菌目(主要是拟杆菌属)和双歧杆菌目的丰度始终维持着显著较低的水平,而乳酸杆菌目,梭菌目和肠杆菌目的水平增加。而FMT处理后,最显著的效果是使拟杆菌目丰度快速正常化。值得注意的是,未经处理的剖宫产婴儿肠道内潜在的病原体如粪便肠球菌、肺炎克雷伯菌、流感嗜血杆菌、空肠弯曲菌和肠炎沙门氏菌等的总体相对丰度持续升高,而经FMT处理的婴儿中却无此情况。此外,未经处理的剖宫产婴儿相对于另外两族而言,其微生物多样性也趋于降低。
对于剖宫产婴儿肠道菌群组定殖而言,最天然的接种物则是母体粪便。在这项研究中,研究人员从17名选择剖宫产分娩方式的母体中筛选出7名参与婴儿的产后FMT(即婴儿首次哺乳时通过口服方式接受母体粪便移植物)。在随后的随访中对婴儿的体征评估正常后,通过16S rRNA基因扩增子测序对婴儿的肠道菌群进行分析,并与母体进行比较。结果显示,接受FMT处理的婴儿样本中的菌群与母体菌群有很大差异,表明移植后微生物在婴儿肠道内的高度选择性生长。 接下来,研究人员从阴道分娩和剖宫产分娩(未经FMT处理)婴儿中收集82个样本并分析其菌群组成。与未经FMT处理的剖宫产婴儿相比,FMT处理后的婴儿总体菌群发育与经阴道分娩的婴儿更相似。为了进一步详细阐明FMT处理婴儿的菌群发育状况,研究人员测试了阴道分娩婴儿与剖宫产分娩的处理和未处理婴儿之间的菌群差异。结果显示,与经阴道分娩的婴儿相比,剖宫产分娩婴儿的拟杆菌目(主要是拟杆菌属)和双歧杆菌目的丰度始终维持着显著较低的水平,而乳酸杆菌目,梭菌目和肠杆菌目的水平增加。而FMT处理后,最显著的效果是使拟杆菌目丰度快速正常化。值得注意的是,未经处理的剖宫产婴儿肠道内潜在的病原体如粪便肠球菌、肺炎克雷伯菌、流感嗜血杆菌、空肠弯曲菌和肠炎沙门氏菌等的总体相对丰度持续升高,而经FMT处理的婴儿中却无此情况。此外,未经处理的剖宫产婴儿相对于另外两族而言,其微生物多样性也趋于降低。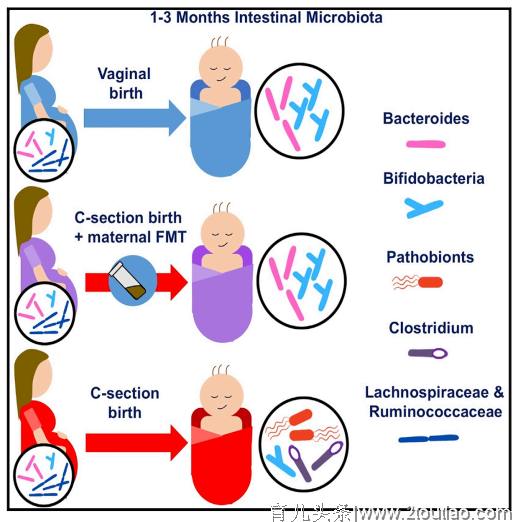 图1. 婴儿肠道菌群构成与分娩方式相关示意图 总体而言,这是一项概念验证(proof-of-concept)的先导研究,研究人员通过将母体粪便菌群以口服方式传递给婴儿,以纠正在剖宫产分娩婴儿中常见的肠道菌群失衡情况(见图1)。尽管这一治疗方式仍需要进行后续监测,但是现阶段观察结果显然是值得期待的,即7名接受治疗的婴儿均未出现并发症,FMT恢复了类似于阴道分娩婴儿的菌群发育情况。重要的是,FMT纠正了剖宫产婴儿中普遍存在的拟杆菌持续缺乏,以及双歧杆菌发育延迟的特征,并且缓解了潜在机会性病原体(例如肠球菌,肠杆菌和克雷伯菌属)水平增加的情况。儿童的免疫系统相关疾病以及代谢性疾病在全球范围内的发病率正在上升,并且是重大的公共卫生负担。尽管因果关系仍有待证明,但许多此类慢性疾病与剖宫产的分娩方式相关,可能至少部分是由于婴儿所暴露的异常微生物群信号引起的【4】。肠道菌群与宿主不断相互作用,向宿主发出信号并影响代谢和免疫功能。尤其是在免疫系统形成的早期阶段,微生物信号被认为特别重要。因此,在剖宫产婴儿中成功恢复正常的垂直菌群转移以及随后菌群发育可能会对这些婴儿的长期健康产生广泛的影响。原文链接:
图1. 婴儿肠道菌群构成与分娩方式相关示意图 总体而言,这是一项概念验证(proof-of-concept)的先导研究,研究人员通过将母体粪便菌群以口服方式传递给婴儿,以纠正在剖宫产分娩婴儿中常见的肠道菌群失衡情况(见图1)。尽管这一治疗方式仍需要进行后续监测,但是现阶段观察结果显然是值得期待的,即7名接受治疗的婴儿均未出现并发症,FMT恢复了类似于阴道分娩婴儿的菌群发育情况。重要的是,FMT纠正了剖宫产婴儿中普遍存在的拟杆菌持续缺乏,以及双歧杆菌发育延迟的特征,并且缓解了潜在机会性病原体(例如肠球菌,肠杆菌和克雷伯菌属)水平增加的情况。儿童的免疫系统相关疾病以及代谢性疾病在全球范围内的发病率正在上升,并且是重大的公共卫生负担。尽管因果关系仍有待证明,但许多此类慢性疾病与剖宫产的分娩方式相关,可能至少部分是由于婴儿所暴露的异常微生物群信号引起的【4】。肠道菌群与宿主不断相互作用,向宿主发出信号并影响代谢和免疫功能。尤其是在免疫系统形成的早期阶段,微生物信号被认为特别重要。因此,在剖宫产婴儿中成功恢复正常的垂直菌群转移以及随后菌群发育可能会对这些婴儿的长期健康产生广泛的影响。原文链接:
 对于剖宫产婴儿肠道菌群组定殖而言,最天然的接种物则是母体粪便。在这项研究中,研究人员从17名选择剖宫产分娩方式的母体中筛选出7名参与婴儿的产后FMT(即婴儿首次哺乳时通过口服方式接受母体粪便移植物)。在随后的随访中对婴儿的体征评估正常后,通过16S rRNA基因扩增子测序对婴儿的肠道菌群进行分析,并与母体进行比较。结果显示,接受FMT处理的婴儿样本中的菌群与母体菌群有很大差异,表明移植后微生物在婴儿肠道内的高度选择性生长。 接下来,研究人员从阴道分娩和剖宫产分娩(未经FMT处理)婴儿中收集82个样本并分析其菌群组成。与未经FMT处理的剖宫产婴儿相比,FMT处理后的婴儿总体菌群发育与经阴道分娩的婴儿更相似。为了进一步详细阐明FMT处理婴儿的菌群发育状况,研究人员测试了阴道分娩婴儿与剖宫产分娩的处理和未处理婴儿之间的菌群差异。结果显示,与经阴道分娩的婴儿相比,剖宫产分娩婴儿的拟杆菌目(主要是拟杆菌属)和双歧杆菌目的丰度始终维持着显著较低的水平,而乳酸杆菌目,梭菌目和肠杆菌目的水平增加。而FMT处理后,最显著的效果是使拟杆菌目丰度快速正常化。值得注意的是,未经处理的剖宫产婴儿肠道内潜在的病原体如粪便肠球菌、肺炎克雷伯菌、流感嗜血杆菌、空肠弯曲菌和肠炎沙门氏菌等的总体相对丰度持续升高,而经FMT处理的婴儿中却无此情况。此外,未经处理的剖宫产婴儿相对于另外两族而言,其微生物多样性也趋于降低。
对于剖宫产婴儿肠道菌群组定殖而言,最天然的接种物则是母体粪便。在这项研究中,研究人员从17名选择剖宫产分娩方式的母体中筛选出7名参与婴儿的产后FMT(即婴儿首次哺乳时通过口服方式接受母体粪便移植物)。在随后的随访中对婴儿的体征评估正常后,通过16S rRNA基因扩增子测序对婴儿的肠道菌群进行分析,并与母体进行比较。结果显示,接受FMT处理的婴儿样本中的菌群与母体菌群有很大差异,表明移植后微生物在婴儿肠道内的高度选择性生长。 接下来,研究人员从阴道分娩和剖宫产分娩(未经FMT处理)婴儿中收集82个样本并分析其菌群组成。与未经FMT处理的剖宫产婴儿相比,FMT处理后的婴儿总体菌群发育与经阴道分娩的婴儿更相似。为了进一步详细阐明FMT处理婴儿的菌群发育状况,研究人员测试了阴道分娩婴儿与剖宫产分娩的处理和未处理婴儿之间的菌群差异。结果显示,与经阴道分娩的婴儿相比,剖宫产分娩婴儿的拟杆菌目(主要是拟杆菌属)和双歧杆菌目的丰度始终维持着显著较低的水平,而乳酸杆菌目,梭菌目和肠杆菌目的水平增加。而FMT处理后,最显著的效果是使拟杆菌目丰度快速正常化。值得注意的是,未经处理的剖宫产婴儿肠道内潜在的病原体如粪便肠球菌、肺炎克雷伯菌、流感嗜血杆菌、空肠弯曲菌和肠炎沙门氏菌等的总体相对丰度持续升高,而经FMT处理的婴儿中却无此情况。此外,未经处理的剖宫产婴儿相对于另外两族而言,其微生物多样性也趋于降低。 图1. 婴儿肠道菌群构成与分娩方式相关示意图 总体而言,这是一项概念验证(proof-of-concept)的先导研究,研究人员通过将母体粪便菌群以口服方式传递给婴儿,以纠正在剖宫产分娩婴儿中常见的肠道菌群失衡情况(见图1)。尽管这一治疗方式仍需要进行后续监测,但是现阶段观察结果显然是值得期待的,即7名接受治疗的婴儿均未出现并发症,FMT恢复了类似于阴道分娩婴儿的菌群发育情况。重要的是,FMT纠正了剖宫产婴儿中普遍存在的拟杆菌持续缺乏,以及双歧杆菌发育延迟的特征,并且缓解了潜在机会性病原体(例如肠球菌,肠杆菌和克雷伯菌属)水平增加的情况。儿童的免疫系统相关疾病以及代谢性疾病在全球范围内的发病率正在上升,并且是重大的公共卫生负担。尽管因果关系仍有待证明,但许多此类慢性疾病与剖宫产的分娩方式相关,可能至少部分是由于婴儿所暴露的异常微生物群信号引起的【4】。肠道菌群与宿主不断相互作用,向宿主发出信号并影响代谢和免疫功能。尤其是在免疫系统形成的早期阶段,微生物信号被认为特别重要。因此,在剖宫产婴儿中成功恢复正常的垂直菌群转移以及随后菌群发育可能会对这些婴儿的长期健康产生广泛的影响。原文链接:
图1. 婴儿肠道菌群构成与分娩方式相关示意图 总体而言,这是一项概念验证(proof-of-concept)的先导研究,研究人员通过将母体粪便菌群以口服方式传递给婴儿,以纠正在剖宫产分娩婴儿中常见的肠道菌群失衡情况(见图1)。尽管这一治疗方式仍需要进行后续监测,但是现阶段观察结果显然是值得期待的,即7名接受治疗的婴儿均未出现并发症,FMT恢复了类似于阴道分娩婴儿的菌群发育情况。重要的是,FMT纠正了剖宫产婴儿中普遍存在的拟杆菌持续缺乏,以及双歧杆菌发育延迟的特征,并且缓解了潜在机会性病原体(例如肠球菌,肠杆菌和克雷伯菌属)水平增加的情况。儿童的免疫系统相关疾病以及代谢性疾病在全球范围内的发病率正在上升,并且是重大的公共卫生负担。尽管因果关系仍有待证明,但许多此类慢性疾病与剖宫产的分娩方式相关,可能至少部分是由于婴儿所暴露的异常微生物群信号引起的【4】。肠道菌群与宿主不断相互作用,向宿主发出信号并影响代谢和免疫功能。尤其是在免疫系统形成的早期阶段,微生物信号被认为特别重要。因此,在剖宫产婴儿中成功恢复正常的垂直菌群转移以及随后菌群发育可能会对这些婴儿的长期健康产生广泛的影响。原文链接:参考文献
1. Ferretti, P., Pasolli, E., Tett, A., Asnicar, F., Gorfer, V., Fedi, S., Armanini, F., Truong, D.T., Manara, S., Zolfo, M., et al. (2018). Mother-to-Infant microbial transmission from different body sites shapes the developing infant gut microbiome. Cell Host Microbe 24, 133–145.e5.2. Andersen, V., Mo ¨ ller, S., Jensen, P.B., Møller, F.T., and Green, A. (2020). Caesarean delivery and risk of chronic inflammatory diseases (Inflammatory Bowel Disease, Rheumatoid Arthritis, Coeliac Disease, and Diabetes Mellitus): A population based registry study of 2,699,479 births in Denmark during 1973- 2016. Clin. Epidemiol. 12, 287–293.3. Blaser, M.J. (2017). The theory of disappearing microbiota and the epidemics of chronic diseases. Nat. Rev. Immunol. 17, 461–463.4. Stiemsma, L.T., and Michels, K.B. (2018). The role of the microbiome in the developmental origins of health and disease. Pediatrics 141, e20172437.2019年热文TOP10